病历摘要
患者女性,53岁,因“恶心、呕吐、发热2个月,血肌酐(Scr)升高3天”入院。
患者于2个月前体检查血、尿常规、肾功能(Scr 0.79 mg/dl)正常,但血钙为2.68 mmol/L,未予重视。4日后出现上感症状,伴低热,体温<38℃,血白细胞升高(16000/mm3),予以“头孢唑啉钠”静滴治疗(剂量不详)1周后体温正常,白细胞降至13200/mm3,并出现消化道症状,以恶心、呕吐为主,无腹痛、腹泻,无消化道出血,予止吐等处理,效果不佳。因消化道症状持续存在,反复加重,严重时饮水即呕吐。进一步查胃镜示“浅表性胃炎”,电解质未见异常。6日前复查Hb 7.8 g/dl,血钾3.1 mmol/L,Scr 3.57 mg/dl,为进一步诊治转入我院。
患者近期有夜尿增多,3~4次/晚,无水肿、少尿、肉眼血尿、高血压,无皮疹、关节痛、面部红斑等。平素体健,无药物过敏史。
入院前1个月和3个月有单位和家庭装修,装修后即入住,气味较重。有染发史7~8年,每年2~4次。
体格检查
中度贫血貌,全身皮肤黏膜苍白,未见出血点、瘀斑。全身浅表淋巴结未触及肿大。结膜苍白,巩膜无黄染。胸骨无明显压痛,两肺呼吸音清,未闻及干湿罗音,心界不大,心律齐,各瓣膜区未闻及病理性杂音。腹平软,无压痛、反跳痛,肝脾肋下未及,移动性浊音(-)。双下肢无水肿。
实验室检查
血常规:Hb 7.8 g/dl,WBC 5100/mm3,中性粒细胞61%,淋巴细胞33%,嗜酸细胞1%,血小板(Plt)15.2万/mm3。网织红细胞1.5%。外周血红细胞碎片阴性。
尿常规:蛋白(-),隐血(-)。24小时尿蛋白定量 0.44 g,大、中、小分子蛋白分别占16.8%、63.7%、19.5%。尿沉渣红细胞计数1万/ml,WBC 10~20/HP,嗜酸细胞计数0。尿C3 2 mg/L,α2微球蛋白2 mg/L。
肾小管功能:NAG酶9.1~16.6 U/g·Cr,视黄醇结合蛋白(RBP) 9.54 mg/L,尿溶菌酶0.5 mg/L,β2微球蛋白 6.2 mg/L,尿氨基酸定量214.2 mg/24 h,尿本周蛋白阴性。尿渗量 267 mOsm/(kg·H2O),尿淀粉酶正常;尿λ轻链 <50 g/L,κ轻链50.5 g/L,钠滤过分数 (FENa) 2.1%,肾衰指数(RFI)2.83。
血生化检查:白蛋白3.66 g/dl,球蛋白2.51 g/dl,胆红素正常,天冬氨酸转氨酶16 U/L,丙氨酸转氨酶23 U/L,乳酸脱氢酶563 U/L,尿素氮27.8 mg/dl,肌酐3.22 mg/dl,尿酸548 μmol/L,碱性磷酸酶 497 U/L,钾2.88 mmol/L,钠134 mmol/L,氯97.4 mmol/L,钙3.88 mmol/L,磷1.43 mmol/L,二氧化碳结合力26.3 mmol/L,胆固醇4.27 mmol/ L,甘油三酯2.41 mmol/ L 。
免疫学检查:IgG、IgA、IgM 分别为10.1、1.72、0.791g/L,IgE 573 IU/ml,补体C3 1.09 g/L ,C4 0.323 g/L,C反应蛋白(CRP )22.9 mg/L、抗链“O”正常。抗核蛋白(ANA)、A-dsDNA阴性。血λ轻链 4.1 g/L,κ轻链7.52 g/L,
肿瘤标志物:甲胎蛋白(AFP) <20 μg/L、癌胚抗原(CEA)0.9 μg/L,铁蛋白 1412.7 ng/ml,人绒毛膜促性腺激素(β-HCG)正常,血β2微球蛋白 7.7 mg/L(正常值 1.51~3.75 mg/L)。
血清甲状旁腺素(PTH)3.93 pg/ml(正常值12~65 pg/ml)。
凝血功能:凝血酶原时间(PT) 12秒,部分凝血活酶时间(APTT )24秒,国际标准化比率(INR)1.04,纤维蛋白原 451 mg/dl;试管法凝血时间正常。
辅助检查
胸部X线未见异常;心电图大致正常。超声检查:左肾(107×48×53) mm3,右肾(104×44×52)mm3,皮质厚度不清,皮质回声增强,皮髓界限不清;脂肪肝,胆囊结石,胰脾未见异常;甲状腺未见异常。
初步诊断:①急性肾功能不全;②高钙血症
诊断分析
患者具有以下临床特点:①53岁女性,病史仅2个月,既往无肾脏病病史。②肾脏表现为非少尿型急性肾功能不全;双肾体积增大。③尿检无蛋白尿、镜下血尿,以肾小管间质损害为主(RBP升高;尿渗量降低;FENa、RFI均大于1)。④生化检查示高钙血症,血钙3.88 mmol/L。⑤除肾脏损害外,病程中消化道症状表现突出。
根据上述特点,急性肾功能不全诊断明确,首先应鉴别是肾前性、肾性还是肾后性因素导致的。
患者起病初有发热、频繁恶心、呕吐,虽然消化道症状明显,但无少尿、低血压、休克等容量不足表现,尿检提示以肾小管间质损害为主,RFI、FENa均大于1,故不支持肾前性因素导致的急性肾功能不全。肾脏B超未见肾盂、输尿管扩张,无结石影,亦可排除肾后性因素导致的急性肾功能不全。高度怀疑为肾实质性疾病导致的急性肾功能不全,但需与一些病因相鉴别。
鉴别诊断
1. 急进性肾小球肾炎 患者病史较短,起病急,临床表现为急性肾功能不全,但尿检无蛋白尿和镜下血尿,血压正常,不支持急进性肾炎。
2. 肾血管病变 患者为中年女性,病史较短,需考虑肾血管病变,尿检无红细胞、蛋白尿,临床上亦无皮疹、关节痛、咯血等系统损害,血像正常,抗中性粒细胞胞浆抗体(ANCA)阴性,不支持系统性血管炎;同时患者无明显少尿、腰痛,无红细胞尿,既往无高血压、高脂血症及高凝倾向,不考虑肾血栓栓塞形成。
3. 急性间质性肾炎 患者起病前曾接受头孢类抗生素治疗,尿检以肾小管间质病变为主,有较多白细胞,虽然IgE偏高,但患者无皮疹、关节痛等表现,血、尿嗜酸细胞不高,故不支持药物导致的急性间质性肾炎。
4. 急性肾小管坏死 患者在出现急性肾功能不全之前,有一过性发热,胃纳差、呕吐等症状,虽然有容量不足因素参与,但患者无少尿、低血压表现,尿检以小管间质损害为主,故不能完全排除急性肾小管坏死。此外患者有严重高钙血症,起病初即有血钙升高2.65 mmol/L,入院时达3.88 mmol/L,临床上消化道症状突出,频繁恶心、呕吐,并逐渐出现肾功能受损,因此不能排除高钙血症导致的肾脏损害。
因此患者接受B超引导下肾活检,光镜下见肾小管间质病变严重,片状小管上皮细胞扁平,刷状缘脱落,少数再生,见小管炎;灶性小管萎缩;腔内见蛋白管型、细胞管型及脱落的上皮细胞。间质增宽,广泛水肿,部分间质尤其髓质间质增宽、纤维化,多处间质及小管腔内见嗜碱性物质(钙盐)。肾小球病变较轻,外周袢脏层上皮细胞附着减少,轻度系膜区增宽,袢开放可,见外周袢与囊壁粘连。动脉管壁增厚、闭锁(图1~3)。免疫荧光 IgA(++),弥漫分布,呈颗粒状沉积于系膜区。IgG、IgM、C3、C4、C1q阴性。多个肾小管腔内聚集的细胞CD3、CD4、CD8、CD68均散在阳性。肾活检证实肾脏病变为高钙血症导致的肾小管间质急性病变。
高钙血症的原因?
因患者存在明显高钙血症,这不仅会出现消化道症状,还可引起肾脏损害,结合病史,患者在短时间内出现进行性贫血,进一步检查发现其头颅、骨盆X线片示多处骨质破坏区,有溶骨改变,腰椎骨折(图5~7)。
虽然患者尿本周蛋白阴性,血浆球蛋白不高,肾组织病理片上未见管型肾病,临床上仍高度怀疑多发性骨髓瘤导致的高钙血症。
为明确病因行骨髓穿刺细胞学检查,发现骨髓增生极度活跃,淋巴细胞异常增生,原始淋巴细胞占92.5%。该类细胞部分为小细胞,胞浆较少,呈天蓝色,部分细胞可见环核带,核圆形,可见凹陷与折叠,染色质较粗,结构较一致,核仁清楚;部分为大细胞,呈圆形或椭圆形,边缘不规则,胞浆量中等,呈天蓝色,核形不规则,可见凹陷与折叠,染色质较疏松细致,核仁清楚,1~3个。POX染色:白血病细胞 100%阴性。染色体核型分型(显带方法 R带,24 h C+D):仅见一个分裂相。流式细胞学:CD19、CD22、CD34阳性,余均阴性。分类示原始淋巴细胞10%,因此最后诊断为急性淋巴细胞白血病(ALL,L1型)。
治疗及随访
患者入院后即给予水化、利尿剂、降钙素、地塞米松及二膦酸盐等对症处理,血钙仍继续上升,最高达4.13 mmol/L,诊断明确后立即转入血液科进行化疗,给予VMP化疗方案即长春地辛(VDS)、米托蒽醌(MIT)及泼尼松(Pred)治疗,同时给予水化、输注红细胞悬液及营养支持治疗。
患者血钙迅速降至正常、肾功能逐渐恢复(图4),外周血原始幼稚淋巴细胞消失,骨髓象示完全缓解。
此后再次给予VDP方案即VDS、柔红霉素(DNR)、Pred和VMP方案化疗。患者肾功能始终正常,尿检阴性,血钙保持在正常范围内。
讨 论
本文所讨论的是一例高钙血症患者,临床上表现为明显的消化道症状伴急性肾功能不全,尿检提出示小管间质损害为主,肾活检证实为高钙血症导致的肾小管间质急性病变。临床上造成高钙血症的原因有多种,对于本例患者主要是由于骨质破坏、溶骨导致的低PTH型高钙血症,经血液学及骨髓细胞学检查,证实为急性淋巴细胞性白血病导致的高钙血症,积极治疗后,患者血钙下降,肾功能恢复正常。
白血病肾脏损害
本例患者为中年女性,有明确的化学物质(有机溶剂)接触史,属于高危人群。白血病可侵犯全身多个脏器系统,不同器官系统受累后,临床表现各具特点。ALL肾脏病变可表现为急性肾衰、急性间质性肾炎或肾小管功能异常。
白血病导致肾损害的发病机制包括以下几方面:
1. 白血病细胞直接浸润肾脏或导致肾出血。白血病细胞直接浸润肾脏临床较多见,常累及双侧肾脏,浸润细胞弥漫分布于肾实质、间质、血管、周围组织及泌尿道,导致肾小球变性、坏死和萎缩。在尸检中的发生率高达50%~100%。ALL更易侵犯肾脏;肾脏出血多为肾实质或肾盂黏膜受累,多见于急性粒细胞性白血病。临床主要表现为肾炎综合征:蛋白尿、血尿、高血压,肉眼血尿等,甚至急进性肾炎。本例患者虽然为ALL,临床上表现为急性肾功能不全,尿检以小管间质损害为主,肾组织中亦未见到明显的细胞浸润及出血,可以排除白血病细胞直接浸润肾脏导致的肾损害。
2. 代谢异常导致的肾损害。白血病患者核蛋白代谢加速,尿酸生成增加,每日尿酸的排出量是正常人的10~40倍,以ALL最高;在化疗过程中容易发生急性肿瘤溶解综合征,肿瘤细胞破坏后产生大量尿酸,可引起急性肾功能不全。尿酸增多的程度与肿瘤细胞的代谢旺盛及毁坏速度有关,大量尿酸盐易沉积在肾小管形成结晶,导致小管间质病变。在急性白血病多表现为急性尿酸性肾病,出现腰痛、少尿、急性肾功能不全,有时伴有肾绞痛,而慢性白血病则表现为泌尿系结石。
3. 易合并感染及抗生素导致的肾损害。白血病患者常合并感染,包括泌尿道感染,临床上表现为腰痛、尿路刺激症、发热、白细胞尿或脓尿。同时由于感染,大量抗生素的使用也易导致肾损害,如肾毒性药物氨基苷类抗生素可导致急性肾小管坏死,出现少尿、急性肾衰;或青霉素类抗生素过敏引起急性间质性肾炎。不同药物导致的肾损害,临床表现不一。
4. 电解质紊乱导致的肾损害。白血病细胞可侵犯骨骼导致骨质破坏,引起高钙血症,进而影响肾脏。高血钙导致的肾脏损害主要在肾小管和集合管。动物试验表明,高血钙可导致肾小管细胞线粒体肿胀,既而钙盐沉积于线粒体、胞浆、小管基膜,逐渐向小管周围的间质发展,引起肾钙质沉积病。
急性高钙血症可以导致肾小球滤过率(GFR)下降,可能与高血钙引起入球小动脉收缩,GFR下降以及血容量减少有关。慢性高钙血症可引起慢性间质性肾炎。白血病细胞本身分泌PTH导致的高钙血症罕见。少数ALL患者以高钙血症起病,本例患者即属于此类,起病初即发现血钙升高,但一直未引起重视。高钙血症累及消化道、肾脏,引起明显临床症状,肾组织上可见较多的钙盐沉积。患者在确诊白血病后,立即给予化疗,血钙迅速下降,肾功能亦恢复正常,从而进一步证实了是白血病引起的高钙血症导致肾脏损害。
高钙血症的治疗
高钙血症的治疗首先应明确病因,对症处理。甲旁亢需积极外科治疗,肿瘤相关的高钙血症必须治疗原发肿瘤,药物导致的高钙血症应立即停药。高钙血症早期应积极治疗,包括水化、利尿、降钙素、激素、二膦酸盐等药物治疗。上述治疗措施中,除降钙素外,通常1~3周后血钙才会下降,虽然降钙素起效较快,但作用短暂,血钙下降幅度有限。
当出现严重高钙血症、或尿量减少、肾功能受损时,可采用血液透析或腹膜透析治疗,不仅能快速降低血钙,而且对肾脏有保护作用。解放军肾脏病研究所报告,采用连续性血液净化(CRRT)治疗高钙血症效果更好,低钙置换液可以迅速有效地降低血清钙,或选用不含钙离子的枸橼酸置换液,这样患者血液中的钙与枸橼酸结合后可降低血钙。
本例患者在未明确高钙血症病因时,虽然也给予积极措施,包括水化、利尿剂、激素、降钙素、二膦酸盐等药物,但疗效差,血钙仍进行性升高,说明一般性治疗措施对该例患者无效。当患者明确诊断为ALL后给予化疗,血钙迅速下降,肾功能恢复正常,说明原发病治疗对纠正高钙血症意义重大。
小结:高钙血症在临床上并不少见,可累及多个脏器系统,应积极寻找病因。白血病导致的高钙血症较少见,因此对于严重贫血、有骨质破坏的患者应尽早行骨髓穿刺明确诊断,从而及时治疗,改善患者预后。
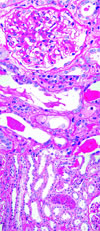
图1-3:肾小管间质病变严重,片状小管上皮细胞扁平,刷状缘脱落;灶性小管萎缩;腔内见蛋白管型、细胞管型 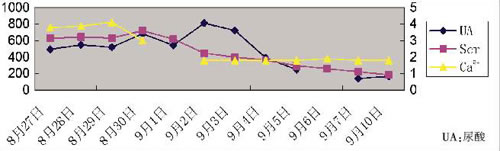
图4 患者肾功能及血钙的变化曲线

图5-7:X线片显示,颅骨、骨盆有多处骨质破坏区,并有腰椎骨折
|

