一、ApoB100
从1966年Margoli和Landgon开始研究ApoB100的结构,不同实验室以特异性蛋白水解酶或化学裂解法研究ApoB的结构,所得ApoB纯度均不尽人意。作者曾于1986年采用特殊的沉淀抽提法获得高纯度的血清ApoB100纯品,以化学裂解法在国内首先报道了ApoB100纯品的氨基酸组成,与Ologsson报道的结果基本一致,如表3-1所示。
表1 人的ApoB100的氨基酸组成
| 种类 | mol/103mol氨基酸 | ||||
| 作者制备的 | Ologsson | Avogaro | Yang | Yang | |
| ApoB100 | ApoLDL | ApoB | ApoB100 | ApoB100 | |
| Lys | 65.26 | 76.9±1.0 | 69.3±1.9 | 67.3 | 78.9 |
| His | 18.46 | 25.1±0.5 | 19.5±1.7 | 25.4 | 23.4 |
| Arg | 34.97 | 35.4±3.3 | 37.0±6.8 | 32.1 | 31.7 |
| Asp | 100.96 | 83.6±1.6 | 94.5±7.4 | 106.2 | 103.6 |
| Thr | 65.12 | 58.1±2.1 | 64.8±3.1 | 63.7 | 67.8 |
| Ser | 81.30 | 72.3±1.8 | 82.0±4.0 | 81.3 | 87.1 |
| Glu | 120.91 | 122.4±2.2 | 130.1±3.1 | 123.8 | 117.4 |
| Pro | 41.07 | 43.7±3.5 | 46.2±3.1 | 37.8 | 40.3 |
| Gly | 57.45 | 54.0±2.4 | 65.3±7.9 | 48.2 | 46.3 |
| Ala | 111.29 | 67.4±1.3 | 72.6±2.7 | 61.1 | 59.5 |
| Val | 59.48 | 59.7±1.3 | 57.0±2.7 | 61.1 | 57.5 |
| 1/2Cystine | 6.72 | 8.0±1.4 | 14.5±2.6 | 6.7 | 5.6 |
| Met | 14.45 | 19.7±0.5 | 16.7±1.4 | 18.1 | 16.4 |
| Ile | 61.97 | 65.4±1.9 | 51.7±1.9 | 61.1 | 58.8 |
| Leu | 123.94 | 130.7±2.5 | 121.2±4.4 | 118.0 | 120.6 |
| Tyr | 34.55 | 34.8±1.4 | 31.0±1.6 | 29.5 | 31.8 |
| Phe | 54.01 | 55.4±2.3 | 38.4±2.6 | 52.8 | 47.6 |
| Trp | 未测 | 未测 | 未测 | 5.7 | 6.5 |
1986年杨朝谕采用生物化学方法,得到人LDL的ApoB100纯品并测出了ApoB100一级结构的氨基酸排列顺序,其结果与从cDNA推导的序列完全一致,从而解决了二十余年悬而未决的难题。
ApoB100是单链糖蛋白,分子量为510kD,主要在肝脏,少数在小肠合成。ApoB100包括27个(或24)氨基酸信号肽和4536个氨基酸残基的成熟单体蛋白。1986年ApoB100的全部氨基酸残基排列顺序结构已阐明。ApoB100分子中含有25个Cys残基,其中有11个Cys残基集中分布在前面500氨基酸组成区域,形成链内二硫健,所以N端高度交联成典型球形结构,Cys残基通过硫脂键与软脂酸硬脂酸以共价键相结合,使ApoB牢固地连接着脂质成份。ApoB100中对脂类结合的必要的结构区域在2035~2506和4002~4527氨基酸残基之间,这两个结构区域重复出现两性亲脂α-螺旋区段。另有一种结合脂质的重要结构是含疏水和亲水性氨基酸交替排列两性亲脂β-折叠结构,这种结构分布在整个分子序列中,但集中于四个富含脯氨酸域,这种富含脯氨酸的重复序列是ApoB100所特有的,使ApoB100能够将磷脂侧链深埋其间并使之紧密结合。由于ApoB100的两性α-螺旋和富含脯氨酸的疏水肽及可被脂酰化的Cys残基形成特殊结构,使得ApoB100能够与单层极性脂牢固地结合并有许多脂质结合区,并使其在VLDL和LDL从分泌到被清除的整个过程中,ApoB100不在脂质白分子间转换,这是与其他载脂蛋白不同之处。LDL上的ApoB100结构如图3-1所示。
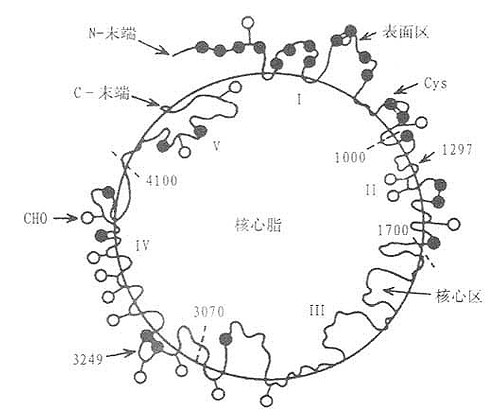
图3-1 LDL上的ApoB100结构图
ApoB100生理功能有:①合成装配和分泌富含甘油三酯的VLDL;②是LDL的结构蛋白;③是LDL受体的配体,调节LDL从血浆中的清除速率。
| 上一页:第二节 载脂蛋白B族 |
| 当前页:一、ApoB100 |
| 下一页:二、ApoB48 |