2.4 膳食蛋白质的利用
2.4.1 蛋白质的消化与吸收
食物蛋白在胃液消化酶的作用下,初步水解,在小肠中完成整个消化吸收过程。胃蛋白酶原从胃底部和幽门部的主细胞分泌,在胃酸和已存在的胃蛋白酶作用下,释出一部分多肽,形成具有活性的胃蛋白酶。胃蛋白酶的作用较弱、专一性较差,除粘液蛋白外,只能促进各种水溶性蛋白质水解成为多肽,主要水解苯丙氨酸、酪氨酸和亮氨酸组成的肽键。
胰液中有胰蛋白酶、胰液乳蛋白酶、弹性蛋白酶等内肽酶和羧基肽酶A与B等外肽酶。胰酶催化蛋白质水解的作用和专一性都较强。作过胃切除术的人,食物蛋白未经胃蛋白酶的作用,其消化率并不受到严重的影响。胰蛋白酶作用于有碱性氨基酸残基的羧基组成的肽键;胰凝乳蛋白酶主要作用于有芳香族氨基酸残基的羧基组成的肽键;弹性蛋白酶作用于有脂肪族氨基酸残基的羧基组成的肽键;羧基肽酶A作用于中性氨基酸残基C端的肽键;羧基肽酶B作用于碱基氨基酸残基的C端的肽键(图2-5)。
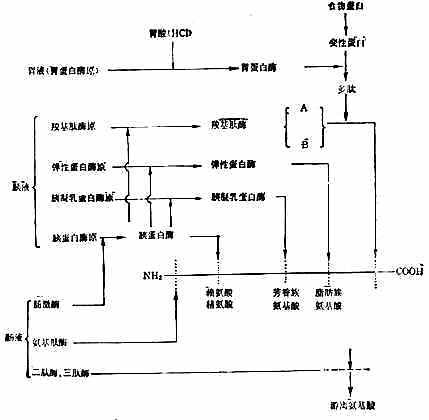
图2-5 胃肠道内蛋白质的消化(根据Gilter修改)
初分泌的各种胰酶都是无活性酶原,排至十二指肠后才被激活发挥作用。胰蛋白酶原被小肠上皮细胞刷状缘表面的肠激酶激活,失N端六肽变成胰蛋白酶。胰蛋白酶再激活胰凝乳蛋白酶原、弹性蛋白酶原和羧基肽酶原,使变成相应的酶(图2-5)。胰蛋白酶原的分泌受肠内食物蛋白的影响,当胰蛋白酶与食物蛋白结合完毕后,多余的胰蛋白酶能抑制胰腺再分泌。
胰酶水解蛋白的产物,仅1/3为氨基酸,其余为寡肽(10个氨基酸以下的肽链)。肠液中肽酶极少,而在肠粘膜细胞的刷状缘和胞液中,分别含有多种寡肽酶,能从肽链的N端逐步水解肽链,称之为氨基肽酶。刷状缘含有的酶能水解2~6个氨基酸组成的肽;肠液中的酶主要水解二肽、三肽。一般认为正常情况下,四肽以上的肽链遇到刷状缘,先水解为三肽或二肽,吸收入细胞后再进一步分解为氨基酸。
L-氨基酸和二、三肽主要通过耗能需钠主动转运从肠壁吸收。在肠粘膜细胞膜上,具有吸收不同种类氨基酸和二、三肽的高度专一性的转运体系。D-氨基酸可能与相应的的L-氨基酸利用同一转运系统,但它和该系统的亲和力远不及L-氨基酸。在蛋白质代谢产物的吸收中,二、三肽的吸收速率比氨基酸快,中性和较为亲水的氨基酸的吸收速率又比碱性和较为疏水的氨基酸为快。
肠道中的蛋白质并非全部来自膳食,还有来自脱落粘膜的上皮细胞和消化酶等内源性蛋白质。据估计成人每天有内源性蛋白35~130g(蛋白质摄入量低时少些)参与体内蛋白质代谢。内源性蛋白不受烹煮和胃酸的作用,而且表面被肠液粘蛋白保护,故较难消化。大部分内源性蛋白质需进入回肠才能充分消化吸收。在回肠末段和大肠中细菌的酶也能分解蛋白质,但人的结肠不能吸收氨基酸,生成的氨基酸只能随粪便排出。
2.4.2 肝脏的作用
摄食蛋白质后,门静脉血中氨基酸的浓度和模式都有改变,但体循环血中氨基酸的变化不大。这是由于肝脏是必需氨基酸(支链氨基酸除外)进行分解代谢的主要场所,肝脏能控制吸入的氨基酸,并能按照机体的需要调节其代谢速率。
大量进食氨基酸后,多余的氨基酸大部分由肝脏降解为尿素,小部分在肝脏用于合成蛋白质。如Elwyn(1970)给狗大量肉食(140g)后,吸入的氨基酸约57%降解为尿素,14%合成肝脏蛋白,6%合成血浆蛋白,其余23%进入体循环。
氨基酸进入肝脏过多时,可以通过酶的作用加以控制。正常情况下,肝脏中分解氨基酸的酶含量相对较少,大量供给氨基酸时,酶的含量适应性地增加,使超过身体需要量的氨基酸分解破坏。
肝脏中蛋白质的合成量,取决于氨基酸摄入量和氨基酸的模式。这可从核蛋白体的合成反映出来。当氨基酸摄入量很少或不平衡时,多核蛋白体解聚为低核蛋白体和单核蛋白体,核糖核酸分解;氨基酸摄入量充足和比例适宜时则相反。
2.4.3 血液氨基酸浓度的调节
血浆游离氨基酸是氨基酸在各组织间转运的主要形式。肝脏通过维持血浆氨基酸的浓度,调整不同摄入量和组织需要量之间的平衡。正常成人血浆游离氨基酸总浓度为350~650mg·L-1,昼夜周期性相差约30%,个别氨基酸昼夜差一般不大于50%。
血浆氨基酸是受肝脏调节,但当氨基酸摄入量超过代谢限度时,血浆氨基酸的浓度会急剧上升。如分别给断乳大鼠和成年大鼠以含不同量色氨酸的饲料,当色氨酸含量超过生长或维持需要的最大量(断乳鼠色氨酸需要量占饲料0.1%、成年鼠色氨酸需要量占饲料0.03%)时,血浆色氨酸浓度增高。这种方法曾用于测定人体必须氨基酸的需要量,如测得成人色氨酸的需要量为3mg/kg体重。这与用氮平衡法得出的需要量结果一致。然而,对其他氨基酸(如赖氨酸)的测定没有得到理想的结果。
血浆氨基酸浓度也受膳食糖的影响。在进食糖后,胰岛素的分泌增多。在胰岛素的作用下,大多数氨基酸进入肌肉,而使血浆中的浓度下降。其中以支链氨基酸的下降最为明显,在进食一次葡萄糖后可降低40%;而某些氨基酸(如色氨酸)受影响很少。
氨基酸进入脑细胞的量,也决定于血浆中其他竞争性氨基酸的浓度。给大鼠色氨酸后,脑中游离色氨酸的含量增高,5-羟色胺增多;给大鼠进食糖,引起血浆中支链氨基酸大幅度下降,促进色氨酸进入脑组织,同样使脑中5-羧色胺增高。
上述作用不仅与5-羧色胺的代谢有关,而且在病理情况下,对脑功能的影响也有重要意义。肝脏硬化、功能不全时,在肠道细菌作用下产生的胺和氨,不能正常地在肝脏分解与转变,而是由循环通过血脑屏障进入脑细胞。如苯丙氨酸在细菌作用下变成苯乙胺,到脑中转变为β-羧酪胺(樟胺),成为与儿茶酚胺竞争的假神经递质。在正常情况下,能被肝脏调节的氨基酸(如色氨酸、苯丙氨酸),这时也不再受控制,随着血浆进入脑组织。另外,在正常情况下,主要在肝脏降解的胰岛素也不再分解。血浆胰岛素含量增高,促进支链氨基酸进入肌肉;血浆支链氨基酸下降,又增加了色氨基酸进入脑细胞的比例。上述种种因素能使脑组织中5-羟色胺产生过多,引起肝昏迷。根据以上论点,给肝昏迷患者以含高支链氨基酸的膳食或输液,能有效地解除症状。
2.4.4 骨骼肌的作用
骨胳肌是身体最大的组织,约占体重的45%。因此,在蛋白质代谢中,肌肉氨基酸的代谢占相当重要的位置。肌肉是氨基酸代谢的场所,也是支链氨基酸代谢的主要场所,在肌肉氨基酸代谢中,胰岛素起重要的调节作用。它能促进氨基酸,特别是支链氨基酸,进入肌肉组织,促进肌肉蛋白的合成,并减缓其分解。肾上腺皮质激素和胰岛素的作用则相反。
测定肌肉蛋白代谢的方法主要有两种,即比较肌肉动静脉血中氨基酸含量的差别和测定尿中3-甲基组氨酸的排出量。
禁食者肌肉中释放大量丙氨酸和谷氨酰胺,其量相当于70kg体重的男子每日丢失75g肌肉蛋白。丙氨酸是由葡萄糖分解产生的丙酮酸与氨基酸分解释出的氨基合成的,通过血液送入肝脏,在肝脏经糖原异生成形成葡萄糖和尿素。前者返回肌肉,重新利用,形成了葡萄糖-丙氨酸循环,后者随尿排出(图2-3)。是氨基酸分解产生的氨基在血液中运输的形式。谷氨酸胺主要进入肠壁组织和肾脏,在肠壁中再转变为丙氨酸而后进入肝脏;在肾脏中分解释出氨,成为尿氨的主要来源,同时也进行糖原异生作用。
3-甲基组氨酸是肌肉中肌动蛋白、肌球蛋白分解时,3-甲基组氨酸的排出量曾用来研究食物成分对肌肉蛋白分解速率的影响。给幼年大鼠普通的、缺乏蛋白质和缺乏热能与蛋白质的三种饲料。发现蛋白质缺乏组,尿中3-甲组氨酸的排出量很快减至原排出量的1/5,补以蛋白质后排出量增高;热能与蛋白质缺乏组,尿中3-甲基氨基酸开始增多,随后逐渐下降。实验表明,蛋白质缺乏时,肌肉蛋白停止分解,而在热能与蛋白质缺乏时,肌肉蛋白先加速分解,然后减慢。印度营养不良的儿童,3-甲基组氨酸的排出量低,营养补充后则升高。减肥者长期禁食,尿中3-甲基组氨酸排出量亦逐渐下降。
尿中3-甲基组氨酸的排出量也受年龄和激素的影响。新生儿每公斤体重的排出量高于成年人,老年人的排出量又比中、青年为低。
2.4.5 氮平衡
体内氮代谢的最终产物主要随尿排出,汗液和脱落的皮屑中含有少量含氮化合物,还有微量的氮随毛发、鼻涕、月经、精液等丢失。肠道中未被吸收的含氮化合物从粪排出。
尿中主要的含氮化合物有尿素、氨、尿酸和肌酸酐,其量随蛋白质的摄入而异(表2-4)。
表2-4 成人不同膳食每日尿氮排出量(g)
| 尿氮来源 | 高蛋白膳 | 低蛋白膳 | 禁食 | |
| 第1天 | 第2天 | |||
| 总氮 | 16.80(100) | 3.60(100) | 10.51(100) | 8.71(100) |
| 尿素氮 | 14.70(87.5) | 2.20(61.7) | 8.96(85.1) | 6.62(75.4) |
| 氨氮 | 0.49(3.0) | 0.42(11.3) | 0.40(3.8) | 1.05(12.0) |
| 尿酸氮 | 0.18(1.1) | 0.09(2.5) | 0.12(1.1) | 0.17(1.9) |
| 尿肌酸酐氮 | 0.58(3.6) | 0.60(17.2) | 0.44(4.2) | 0.39(4.4) |
| 其他氮 | 0.85(4.9) | 0.27(7.3) | 0.59(5.6) | 0.54(6.1) |
注:()内为尿总氮的%
普通膳食时,尿素氮占总氮量80%以上;低蛋白膳时,尿素氮降低;饥饿时,氨氮增高。尿肌酸酐的排出量似乎与膳食蛋白的含量无关。
组织蛋白的分解代谢和合成代谢处于动态平衡,这种平衡可用氮平衡表示:
B=I棧?/FONT>U+F+S)
氮平衡(B)是摄入氮量(I)和排出氮量[尿氮(U)、粪氮(F)、皮肤(S)]的差数。成年人摄入和排出的氮量大致相等,B等于或接近零(摄入氮的±5%以内),称为氮平衡;儿童在生长发育时期,有一部分蛋白质在体内储留,B为正数,称为正氨平衡;衰老、短暂的饥饿或某些消耗性疾病,排出氮量大于摄入氮量,B为负数,称为负平衡。
氮的摄入量和排出量可用实验方法测得。在测定中,由于食物未完全消化,摄入量的计算往往偏高;由于样品丢失或忽略不计,排出量的计算往往偏低。两者误差的总和可使摄入量和排出量相差10~15%。
氮平衡受热能摄入量的影响,热能有节省蛋白质的作用。如1973年FAO/WHO专家委员会报告,给受试者蛋白质0.57g·kg-1体重,当热能供给量充裕时,出现正氮平衡;而当热能供给量在维持水平时,出现负氮平衡。氮平衡还受生长激素、睾酮、皮质类固醇和甲状腺素等激素的影响。这些激素有促进蛋白质合成的作用,或促进蛋白质分解、抑制合成的作用。
| 上一页:2.3 蛋白质的生理功用 |
| 当前页:2.4 膳食蛋白质的利用 |
| 下一页:2.5 蛋白质和氨基酸的需要量 |