第四节 各类免疫球蛋白的特点
五类免疫球蛋白都有结合抗原的共性,但它们在分子结构、体内分布、血清水平及生物活性等方面又各具特点(表2-2)。
表2-2五类Ig的代谢、分布及生物活性
| 性状 | IgG | IgA | IgM | IgD | IgE |
| 血清含量(mg/dL) | 1200 | 200 | 120 | 3 | 0.04 |
| 相对含量(%) | 75~85 | 10~15 | 5~10 | 0.05 | 0.03 |
| 合成率(mg/kg·d) | 33 | 24 | 7 | 0.4 | 0.02 |
| 分解率(%/d) | 7 | 25 | 8 | 37 | 71 |
| 半衰期(d) | 23 | 6 | 5 | 3 | 2 |
| 血管内分布(%) | 50 | 50 | 80 | 75 | 50 |
| 外分泌液中 | - | + | ± | - | + |
| 结合补体 | + | - | + | - | - |
| 透过胎盘 | + | - | - | - | - |
| 与肥大细胞结合 | (IgG4) | - | - | - | + |
| 与Mφ和B-C结合 | + | - | - | - | + |
(一)IgG
IgG为标准的单体Ig分子,含1个或更多的低聚糖基团,电泳速度在所有血清蛋白中最慢。IgG是再次免疫应答的主要抗体,具有吞噬调理作用、中和毒素作用、中和病毒作用、介导ADCC、激活补体经典途径、并可透过胎盘传输给胎儿;IgGFc片段可结合类风湿因子及其他抗γ球蛋白抗体,致敏异种(豚鼠)皮肤;还有抗核抗体、抗Rh抗体、肿瘤封闭抗体等均属IgG;因而IgG有多能免疫球蛋白之称。
IgG合成速度快、分解慢、半衰期长,在血内含量最高,约占整个Ig的75%;各亚类所占比例大约为:IgG160%~70%,IgG215%~20%,IgG35%~10%,IgG41%~7%,各亚类的比例随年龄及遗传背景而有变化;同时各亚类的生物学和免疫学性质也不尽相同(表2-3)。
表2-3IgG各亚类的生物活性
| 性状 | IgG1 | IgG2 | IgG3 | IgG4 |
| 激活补体 | ++ | + | +++ | - |
| 透过胎盘 | +++ | +++ | +++ | +++ |
| 结合FcγRⅠ | +++ | - | +++ | ++ |
| 结合FcγRⅡ | +++ | + | +++ | - |
| 结合FcγRⅢ | +++ | - | +++ | - |
| 结合A蛋白 | +++ | +++ | ± | +++ |
| 结合G蛋白 | +++ | +++ | +++ | +++ |
| 结合类风湿因子 | ++ | ++ | ++ | ++ |
| 致敏异种皮肤 | ++ | - | ++ | ++ |
| 中和毒素 | +++ | + | + | ++ |
| 抗Rh抗体 | +++ | - | +++ | - |
(二)IgM
IgM为五聚体,是Ig中分子最大者。分子结构呈环形,含一个J链,各单位通过μ链倒数第二位的二硫键与J链互相连接。结构模式见图2-4。μ链含有5个同源区,其CH3和CH4相当于IgG的CH2和CH3,无铰链区。
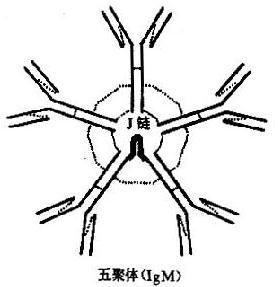
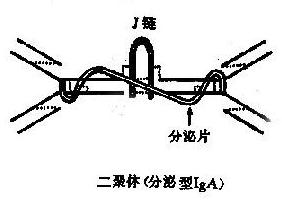
图2-4免疫球蛋白多聚体结构
从化学结构上看,IgM结合抗原的能力可达10价,但实际上常为5价,这可能是因立体空间位阻效应所致。当IgM分子与大颗粒抗原反应时,5个单体协同作用,效应明显增大。IgM凝集抗原的能力比IgM大得多,激活补体的能力超过IgG1000倍;由于吞噬细胞缺乏IgM的特异受体,因而IgM没有独立的吞噬调理作用;但当补体存在时,它能通过C3b与巨噬细胞结合以促进吞噬。虽然IgM单个分子的杀菌和调理作用均明显高于IgG抗体,但因其血内含量低、半衰期短、出现早、消失快、组织穿透力弱,故其保护作用实际上常不如IgG。
血型同种凝集素和冷凝集素的抗体类型是IgM,不能通过胎盘,新生儿脐血中若IgM增高,提示有宫内感染存在。在感染或疫苗接种以后,最先出现的抗体是IgM;在抗原的反复刺激下,可通过Ig基因的类转换而转向IgG合成。当分泌物中IgA缺陷时,IgM也和IgA一样可结合分泌片而替代IgA。IgM也是B细胞中的主要表面膜Ig,作为抗原受体而引发抗体应答。
(三)IgA
IgA分为血清型和分泌型两种类型。
大部分血清IgA为单体,大约10%~15%为双聚体,也发现少量多聚体。IgA功能区的分布与IgG十分相似,两个亚类(IgA1和IgA2)的最大差异在铰链区。IgA2缺少H-L链间二硫键区域,容易被解离分开。从含量、稳定性和半衰期看,血清型IgA虽不如IgG,但高于其他类Ig。IgA可以结合抗原,但不能激活补体的经典途径,因此不能象IgG那样发挥许多的生物效应,所以过去曾误以为血清型IgA的意义不大;近年的研究发现,循环免疫复合的抗体中有相当比例的IgA,因而认为:血清型IgA以无炎症形式清除大量的抗原,这是对维持机体内环境稳定的非常有益的免疫效应。
分泌型IgA(SigA)为双聚体,沉降系数11S,分子量400kD。每一SigA分子含一个J链和一个分泌片(图2-4)。α链、L链和J链均由浆细胞产生,而分泌片由上皮细胞合成。J链通过倒数第二位二硫键将2个IgA单体互相连接;结合分泌片后SIgA的结构更为紧密而不被酶解,有助于SIgA在粘在粘膜表面及外分泌液中保持抗体活性。外分泌液中的高浓度IgA主要为局部合成,特别是在肠相关淋巴样组织(GALT)内。
分泌型IgA性能稳定,在局部浓度大,能抑制病原体和有害抗原粘附在粘膜上,阻挡其进入体内;同时也因其调理吞噬和溶解作用,构成了粘膜第一线防御机制;母乳中的分泌型IgA提供了婴儿出生后4~6月内的局部免疫屏障;因此常称分泌型IgA为局部抗体。有关SIgA的免疫作用参见第七章。
(四)IgD
IgD的分子结构与IgG非常相似,有明显的铰链区,其蛋白质高度糖基化。IgD性能不稳定,在分离过程中易于聚合,又极易被酶裂解。虽然有些免疫应答可能与特异性IgD抗体有关,但它并不能激活任何效应系统。某些自身免疫病及过敏反应病患者血中存在IgD类抗核抗体或抗青霉素IgD抗体。正常人血清内IgD浓度很低,但在血循环内B细胞膜表层可检出IgD,其功能主要是作为B细胞表面的抗原受体。在B细胞发育的某些阶段,膜IgD的合成增强。大部分慢性淋巴细胞白血病病人B细胞表面带膜IgD,并常同时有膜IgM。
(五)IgE
IgE为单体结构,分子量大于IgG和单体IgA,含糖量较高,ε链有6个低聚糖侧链。象IgM一样,IgE也有5个同源区,CH2功能区置换了其他类重链的铰链区。正常人血清中IgE水平在5类Ig中最低,分布于呼吸道和肠道粘膜上的IgE稍多,可能与IgE在粘膜下淋巴组织内局部合成有关。IgE水平与个体遗传性和抗原质量密切相关,因而其血清含量在人群中波动很大,在特应性过敏症和寄生虫感染者血清中IgE水平可升高。IgE不能激活补体及穿过胎盘,但它的Fc段能与肥大细胞和嗜碱性粒细胞表面的受体结合,介导Ⅰ型变态反应的发生,因此又称亲细胞抗体。
| 上一页:第三节 免疫球蛋白的生物学活性 |
| 当前页:第四节 各类免疫球蛋白的特点 |
| 下一页:第五节 免疫球蛋白的基因及抗体形成 |